Cellules endothéliales dans l’immunité, l’inflammation et le cancer

Responsable d'équipe
Notre équipe figure parmi les leaders mondiaux pour la caractérisation des vaisseaux sanguins HEV (high endothelial venules), portes d’entrée des lymphocytes dans les organes lymphoïdes, et les tissus enflammés et tumoraux, et pour l’étude de l’interleukine 33 (IL-33), une cytokine nucléaire de la famille IL-1 que nous avons découverte en 2003 et qui joue des rôles cruciaux dans l’immunité innée et l’inflammation allergique.
L'expertise unique et pluridisciplinaire de notre équipe est un atout majeur pour étudier les rôles des vaisseaux sanguins HEV et de l'IL-33 dans l'immunité, l'inflammation et le cancer.

Nous avons démontré que les cellules dendritiques, bien connues pour leur rôle de cellules présentatrices d’antigènes, jouent un rôle inattendu et important dans la régulation des vaisseaux sanguins HEV des ganglions lymphatiques (Nature 2011). En utilisant la technique de RNAseq sur cellule unique, nous avons identifié les gènes impliqués dans le dialogue entre les cellules endothéliales des vaisseaux HEV et les cellules dendritiques (Cell Rep 2019). Il y a une dizaine d’années, nous avons découvert la présence fréquente de vaisseaux sanguins de type HEV (TA-HEVs) dans les tumeurs solides humaines, et leur association avec l’infiltration de lymphocytes cytotoxiques et une évolution clinique favorable dans le cancer du sein (Cancer Res 2011, 311 citations). Notre étude a introduit un nouveau concept en cancérologie: “Les vaisseaux sanguins dans les tumeurs humaines ne sont pas tous identiques et certains types de vaisseaux trouvés dans le microenvironnement tumoral (vaisseaux TA-HEVs) peuvent contribuer à l’inhibition de la croissance des tumeurs plutôt qu’à leur développement”. Nous avons récemment démontré que les TA-HEVs permettent l’entrée des lymphocytes dans les tumeurs au cours des réponses immunitaires antitumorales et de l’immunothérapie contre le cancer, et sont associés à une meilleure réponse clinique des patients atteints de mélanome métastatique et traités par immunothérapie anticancéreuse anti-PD-1/anti-CTLA-4 (Cancer Cell 2022). Nous travaux suggèrent que de nouvelles stratégies thérapeutiques basées sur la modulation des vaisseaux TA-HEVs pourraient avoir un impact majeur sur l’immunité antitumorale et la réponse à l’immunothérapie des patients atteints de cancer.
L’IL-33 est une cytokine nucléaire de la famille IL-1 que nous avons initialement découverte comme un facteur nucléaire majeur des vaisseaux HEV (NF-HEV) (PNAS 2007, 756 citations). Nous avons observé que l’IL-33 est exprimée à des niveaux élevés dans les vaisseaux sanguins et les tissus des barrières épithéliales (PLoS 2008, 875 citations), et qu’elle fonctionne comme un signal d’alarme (alarmine) libéré lors de dommages cellulaires pour alerter les cellules immunitaires exprimant le récepteur de l’IL-33, ST2 (PNAS 2009, 510 citations). Ces cellules immunitaires incluent divers types de cellules impliquées dans l’immunité de type 2 et l’inflammation allergique telles que les mastocytes et les cellules lymphoïdes innées du groupe 2 (ILC2). Nous avons démontré que les protéases inflammatoires peuvent générer des formes tronquées d’IL-33 qui sont 30 fois plus puissantes que la protéine pleine taille pour l’activation des ILC2s (PNAS 2012, 389 citations, PNAS 2014). De plus, nous avons découvert que l’IL-33 pleine taille fonctionne comme un ‘senseur’ de protéase qui détecte les activités protéolytiques associées à une grande variété d’allergènes environnementaux (Nat Immunol 2018, 174 citations). Un objectif important de notre équipe est de mieux caractériser la régulation et les mécanismes d’action de l’IL-33 in vivo, grâce à l’utilisation d’approches multidisciplinaires.
Équipe
Chercheurs-Enseignants chercheurs
Corinne Cayrol (CR HC, CNRS)
Jean-Philippe Girard (DR, CE Inserm)
Emma Lefrançais (CR CNRS)
Nathalie Ortéga (MCU, UPS)
Ingénieurs
Elisabeth Bellard (CNRS)
Pascale Mercier (CNRS)
Stéphane Roga (CNRS)
Clara Saint-Martin
Dorian Tarroux
Post-doctorante
Jade Hebras
Doctorants
Léa Fromont
Lucie Gelon
Jerko Ljubetic
Estefania Vina-Barrientos
Asrir*, Tardiveau*, Coudert*, Laffont*, Blanchard* et al. (2022) Tumor-associated high endothelial venules mediate lymphocyte entry into tumors and predict response to PD-1 plus CTLA-4 combination immunotherapy. Cancer Cell
Cayrol*, Duval* et al. (2018) Environmental allergens induce allergic inflammation through proteolytic maturation of IL-33. Nat Immunol
Lefrançais*, Duval* et al. (2014) Central domain of IL-33 is cleaved by mast cell proteases for potent activation of group-2 innate lymphoid cells. Proc Natl Acad Sci USA
Martinet*, Garido* et al. (2011) Human solid tumors contain high endothelial venules (HEV): association with T and B lymphocyte infiltration and favourable prognosis in breast cancer. Cancer Res
Moussion and Girard (2011) Dendritic cells control lymphocyte entry to lymph nodes via high endothelial venules. Nature
Cayrol and Girard (2009) The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1. Proc Natl Acad Sci USA
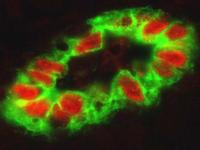
Les cellules endothéliales qui tapissent la paroi des vaisseaux HEV (‘High endothelial venules’, en vert) experiment de hauts niveaux de la cytokine nucléaire interleukine-33 (IL-33, en rouge). © Jean-Philippe Girard

Jean-Philippe Girard figure parmi les scientifiques les plus cités au monde dans la prestigieuse liste « Highly Cited Researchers » en 2019, 2020, 2022 et 2023 dans la catégorie Immunologie.
Jean-Philippe Girard et l’IPBS mis à l’honneur dans le film « Paroles de chercheurs » de la Fondation ARC
Jean-Philippe Girard reçoit le Grand Prix Oberling-Haguenau de la Fondation ARC
Jean-Philippe Girard figure parmi les « Highly Cited Researchers » 2023 dans la catégorie Immunologie
Lucas Blanchard, lauréat du Prix de l’Université Paul Sabatier (Sciences de la vie ou de la terre) de l’Académie des Sciences, Inscriptions et Belles-Lettres de Toulouse
Jean-Philippe Girard figure parmi les Highly Cited Researchers 2022 dans la catégorie Immunologie
Respiratory allergies: newly discovered molecule plays a major role in triggering inflammation
Cancer treatment: Identification of the blood vessels that allow killer lymphocytes to access and destroy tumors
Single cell analysis of specialized blood vessels that mediate lymphocyte entry to lymphoid organs
How allergens trigger asthma attacks
Identification of a critical actor controlling trafficking of leukemia cells
Key step in allergic reactions revealed
A novel mechanism in the activation of IL-33 during inflammation
Blood vessels participate in the eradication of tumors
Dendritic cells control lymphocyte entry into lymph nodes
The complete list of our publications is available through Pubmed
Main publications on the HEV topic
- Martinet, L.*, Garrido, I.*, Filleron, T., Le Guellec, S., Bellard, E., Fournie, J.J., Rochaix, P., Girard, J.P. (2011) Human solid tumors contain high endothelial venules: association with T- and B-lymphocyte infiltration and favorable prognosis in breast cancer. Cancer Res 71, 5678-5687 (Press release from CNRS/INSERM; This article has been highlighted in Cancer Res 71:5601-5; 311 citations in Web of Science, WoS)
We went against the dogma that ‘blood vessels facilitate tumor growth’ and introduced a novel concept in cancer biology: ‘Blood vessels in human tumors are not all the same and some types of blood vessels (i. e. tumor-associated HEVs) may contribute to the fight against cancer’.
- Moussion, C., Girard, J.P. (2011) Dendritic cells control lymphocyte entry to lymph nodes through high endothelial venules. Nature 479, 542-546 (Press release from CNRS/INSERM; 210 citations in WoS)
We showed that dendritic cells, which are well known for their role as antigen-presenting cells, play an unexpected and important role in the maintenance of HEV blood vessels in adult lymphoid tissues.
- Martinet, L., Le Guellec, S., Filleron, T., Lamant, L., Meyer, N., Rochaix, P., Garrido, I., Girard, J.P. (2012) High endothelial venules (HEVs) in human melanoma lesions: Major gateways for tumor-infiltrating lymphocytes. Oncoimmunology 1, 829-839 (137 citations in WoS)
We found that high densities of tumor-associated HEVs are correlated with high levels of lymphocyte infiltration and favorable clinical characteristics in primary human melanomas.
- Lafouresse, F., Bellard, E., Laurent, C., Moussion, C., Fournie, J.J., Ysebaert, L., Girard, J.P. (2015) L-selectin controls trafficking of chronic lymphocytic leukemia cells in lymph node high endothelial venules in vivo. Blood126, 1336-1345 (Press release from CNRS/INSERM; This article has been selected by the Editors for the cover of the journal and a research highlight in “Inside Blood” 2015, 126:1267-1268)
We used intravital microscopy in mouse to study the in vivo trafficking in HEVs of human leukemic cells from chronic lymphocytic leukemia patients.
- Veerman, K., Tardiveau, C., Martins, F., Coudert, J., Girard, J.P. (2019) Single-Cell Analysis Reveals Heterogeneity of High Endothelial Venules and Different Regulation of Genes Controlling Lymphocyte Entry to Lymph Nodes. Cell Rep 26, 3116-3131 e3115
We reported the 1st characterization of the full-length HEV transcriptome by single cell RNA-sequencing, discovered the heterogeneity of HEV endothelial cells in homeostatic and inflamed lymph nodes and revealed important differences in the regulation of HEV genes after interruption of LTbR signaling.
- Asrir, A.#, Tardiveau, C.#, Coudert, J.#, Laffont, R.#, Blanchard, L.#, Bellard, E., Veerman, K., Bettini, S., Lafouresse, F., Vina, E., Tarroux, D., Roy, S., Girault, I., Molinaro, I., Martins, F., Scoazec, J.Y., Ortega, N., Robert, C., Girard, J.P. (2022) Tumor-associated high endothelial venules mediate lymphocyte entry into tumors and predict response to PD-1 plus CTLA-4 combination immunotherapy. Cancer Cell 40, 318-334 e319 (#Co-first authors)
Using intravital microscopy, we demonstrated that TA-HEVs are major sites of lymphocyte entry into tumors during anti-tumor immune responses and cancer immunotherapy. We also showed that TA-HEVs are associated with better clinical response and survival of metastatic melanoma patients treated with anti-PD-1/anti-CTLA-4 dual immunotherapy.
Reviews on the HEV topic
- Girard, J.P.*, Moussion, C., Forster, R. (2012) HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes. Nat Rev Immunol 12, 762-773 (* Corresponding author; 435 citations in WoS, Top 1%)
We were invited by the Nature Rev Immunol Chief Editor to write a comprehensive review on the role of HEV blood vessels in lymphocyte migration to lymph nodes.
- Blanchard, L., Girard, J.P. (2021) High endothelial venules (HEVs) in immunity, inflammation and cancer. Angiogenesis 24, 719-753
We wrote a landmark review on the function and regulation of HEV blood vessels in immunity, inflammation and cancer (34 pages, 339 references).
Main publications on the IL-33 topic
- Baekkevold, E., Roussigné, M., Johansen, F.E., Jahnsen, F., Amalric, F., Erard, M., Brandtzaeg, P., Haraldsen, G., Girard, J.P. (2003) Molecular characterization of NF-HEV – a nuclear factor preferentially expressed in human high endothelial venules. Am J Path 163, 69-79 (354 citations in WoS)
We discovered a novel nuclear factor abundantly expressed in HEV endothelial cells in human lymphoid organs, that we designated nuclear factor of HEV (NF-HEV).
- Carriere, V.*, Roussel, L.*, Ortega, N., Lacorre, D.A., Americh, L., Aguilar, L., Bouche, G., Girard, J.P. (2007) IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factor in vivo. Proc Natl Acad Sci USA 104, 282-287 (*first co-autors; This article has been highlighted in Science Signalling 2007(390):pe31; 765 citations in WoS)
We showed that the IL-1-like cytokine IL-33 is a chromatin-associated cytokine, which is identical to NF-HEV, the nuclear factor that we cloned from purified HEV endothelial cells in 2003.
- Moussion, C.*, Ortega, N.*, Girard, J.P. (2008) The IL-1-like cytokine IL-33 is constitutively expressed in the nucleus of endothelial cells and epithelial cells in vivo: a novel ‘alarmin’? PLoS One 3, e3331 (*co-first authors, 875 citations in WoS)
We reported that IL-33 is constitutively expressed in blood vessels and epithelial barrier tissues, and we proposed the concept that IL-33 may function as a novel alarmin (alarm signal) rather than as a classical cytokine (we were the first to propose this concept).
- Roussel, L., Erard, M., Cayrol, C., Girard, J.P. (2008) Molecular mimicry between IL-33 and KSHV for attachment to chromatin through H2A-H2B acidic pocket. EMBO Rep 9, 1006-1012 (213 citations in WoS)
We discovered a unique example of molecular mimicry between a virus and a nuclear cytokine, and proposed that Kaposi’s sarcoma virus hijacked the chromatin-binding domain of IL-33 in order to maintain the viral genome in infected cells.
- Cayrol, C., Girard, J.P. (2009) The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1. Proc Natl Acad Sci USA 106, 9021-9026 (This article has been highlighted in Immunity 2009, 31:5-7; 510 citations in WoS)
Contrary to the dogma in the field, we showed that IL-33 does not require maturation for biological activity and that cleavage by caspases results in IL-33 inactivation, rather than activation (We were the first to report these findings, which were later confirmed by 3 other teams).
- Lefrancais, E., Roga, S., Gautier, V., Gonzalez-de-Peredo, A., Monsarrat, B., Girard, J.P.*, Cayrol, C*. (2012) IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G. Proc Natl Acad Sci USA 109, 1673-1678 (* Co-senior authors; Press release from CNRS/INSERM; 389 citations in WoS, Top 1%)
We showed that processing of IL-33 by inflammatory proteases generate mature forms of the cytokine with highly increased biological activity.
- Pichery, M.#, Mirey, E.#, Mercier, P., Lefrancais, E., Dujardin, A., Ortega, N.*, Girard, J.P.* (2012) Endogenous IL-33 Is Highly Expressed in Mouse Epithelial Barrier Tissues, Lymphoid Organs, Brain, Embryos, and Inflamed Tissues: In Situ Analysis Using a Novel Il-33-LacZ Gene Trap Reporter Strain. J Immunol 188, 3488-3495 (# Co-first authors; * Co-senior authors; 339 citations in WoS, Top 1%)
We reported the atlas of IL-33 protein expression and Il33 promoter activity in mouse embryos and adult tissues at steady state and during inflammation.
- Lefrancais, E.#, Duval, A.#, Mirey, E., Roga, S., Espinosa, E., Cayrol, C.*, Girard, J.P.* (2014) Central domain of IL-33 is cleaved by mast cell proteases for potent activation of group-2 innate lymphoid cells. Proc Natl Acad Sci USA 111, 15502-15507 (# co-first authors,* Co-senior authors; Press release from CNRS/INSERM; This article has been highlighted in JACI, 2015, 135:1-2; 246 citations in WoS).
We discovered that cleavage within the central domain of IL-33 generates truncated forms that are 30-fold more potent than the native protein for activation of ILC2s, the major targets of IL-33 in vivo.
- Cayrol, C.#, Duval, A.#, Schmitt, P., Roga, S., Camus, M., Stella, A., Burlet-Schiltz, O., Gonzalez-de-Peredo, A., Girard, J.P.* (2018) Environmental allergens induce allergic inflammation through proteolytic maturation of IL-33. Nat Immunol 19, 375-385 (# Co-first authors; *Co-corresponding author; National press release from INSERM/CNRS; This article has been highlighted in Nature Immunol. 2018 News and Views 19:318-320 and Nature Rev Immunol 2018 May issue; Recommended in F1000Prime, 174 citations in WoS, Top 1%).
We discovered that IL-33 functions as an allergen protease sensor that detects proteolytic activities associated with various clinically relevant aeroallergens and initiates allergic inflammation shortly after allergen exposure.
Reviews on the IL-33 topic
- Cayrol, C., Girard, J.P. (2014) IL-33: an alarmin cytokine with crucial roles in innate immunity, inflammation and allergy. Curr Opin Immunol 31, 31-37 (453 citations in WoS, Top 1%)
We were invited to write a state of the art review on IL-33 mode of action, regulation and functions in health and disease.
- Liew, F.Y., Girard, J.P., Turnquist, H.R. (2016) Interleukin-33 in health and disease. Nat Rev Immunol 16, 676-689 (617 citations in WoS, Top 1%)
We were invited to write a state of the art review on IL-33 protein and its roles in immunity and allergic inflammation.
- Cayrol, C., Girard, J.P. (2018) Interleukin-33 (IL-33): A nuclear cytokine from the IL-1 family. Immunol Rev 281, 154-168 (404 citations in WoS, Top 1%)
We were invited to write a state of the art review on IL-33 mode of action and regulation.
- Cayrol, C., Girard, J.P. (2022) Interleukin-33 (IL-33): A critical review of its biology and the mechanisms involved in its release as a potent extracellular cytokine. Cytokine 156, 155891
We were invited to make a critical review of IL-33 biology. Importantly, we alerted the scientific community to the problems of specificity of IL-33 reagents, and we made recommendations to generate reliable results.
Patent
Title : NOVEL SUPERACTIVE IL-33 FRAGMENTS, AND USES THEREOF
Publication N° WO/2012/113927
Publication Date: 30.08.2012
International Application No PCT/EP2012/053199
Applicants: CNRS
Inventors: GIRARD, Jean-Philippe;CAYROL-GIRARD, Corinne; LEFRANCAIS, Emma

